Efecto de un inoculante microbiano sobre la calidad microbiológica y nutricional de ensilaje de Morus alba L.
y Sambucus nigra L.
Effect of a microbial inoculant on the microbiological and nutritional quality
of Morus alba L. and Sambucus nigra L. silage.
Efeito de um inoculante microbiano na qualidade microbiológica e nutricional
da silagem de Morus alba L. e Sambucus nigra L.
Dania Fonseca-Lópeza,* | Carlos-Eduardo Rodríguez-Molanob
a https://orcid.org/0000-0003-3877-3730
b https://orcid.org/0000-0002-0862-3478
Universidad Pedagógica y Tecnológica de Colombia, Tunja, Colombia
Resumen
El ensilaje es un proceso que se realiza para conservar alimentos a partir de una fermentación anaerobia y producción de ácido láctico, pero su efectividad depende de factores como el sustrato y los microorganismos dominantes. Por ello, el objetivo de este trabajo fue determinar el efecto de un inoculante bacteriano sobre la calidad composicional y microbiológica de ensilaje a base de morera (Morus alba L.) y sauco (Sambucus nigra L.). Para ello se picó (3-5 cm) el material vegetal y se mezcló en proporción del 50:50 con inoculante liofast® (15%, 10%) y se fermentó durante 28 días. Se obser-vó mayor pérdida volumétrica (materia seca) y crecimiento de enterobacterias (190 × 10-9 UFC.g-1) con el uso de inoculante (15%).
Palabras clave: ensilaje, fermentación-anaerobia, preservación de alimentos, plantas forrajeras, morera
Summary
Silage is a process used to preserve food from anaerobic fermentation and lactic acid production. However, its effectiveness depends on factors such as the substrate and the dominant microorganisms. The objective of this work was to determine the effect of a bacterial inoculant on the compositional and microbiological quality of silage based on mulberry (Morus alba L.) and elderberry (Sambucus nigra L.). The plant material was chopped (3-5 cm) and mixed in a 50-50 ratio with liofast® inoculant (15%, 10%) and fermented for 28 days. Greater volumetric loss (dry matter) and growth of enterobacteria (190 × 10-9 CFU.g-1) was observed with the use of the inoculant (15%).
Keywords: Silage, fermentation-anaerobia, food preservation, fodder plants, mulberry tree
Sumário
A silagem é um processo realizado para conservar os alimentos a partir de uma fermentação anaeróbica e produção de ácido lático, mas sua eficácia depende de fatores como o substrato e os microorganismos dominantes. Portanto, o objetivo deste trabalho foi determinar o efeito de um inoculante bacteriano na qualidade composicional e microbiológica de silagem à base de amoreira (Morus alba L.) e sabugueiro (Sambucus nigra L.). Para isso, o material vegetal foi picado (3-5 cm) e misturado
em uma proporção de 50:50 com inoculante liofast® (15%, 10%) e fermentado por 28 dias. Observou
-se uma maior perda volumétrica (matéria seca) e crescimento de enterobactérias (190 × 10-9 UFC.g-1) com o uso de inoculante (15%).
Palavras-chave: Silagem, fermentação-anaeróbia, conservação de alimentos, plantas forrageiras, amoreira
La ganadería sostenible se orienta hacia la utilización de estrategias que reduzcan la emisión de gases efecto invernadero y la huella de carbono para contribuir con la conservación del medio ambiente, a través de la menor dependencia de insumos externos como los alimentos concentrados mediante la inclusión de alternativas forrajeras para el trópico como la morera (Morus alba L.) y el sauco (Sambucus nigra) en los sistemas productivos.
Estas especies arbóreas tienen distribución mundial por crecer en diferentes condiciones climáticas y son de interés pecuario por su alto rendimiento foliar (Chakraborty, Kundu & Chattopadhyay, 2016) y la calidad nutricional de sus hojas gracias a su contenido de proteína cruda degradable comparable con leucaena (Leucaena leucocephala) y fixus (Ficus roxburghii) (Wang, Yang, Bo, Ding & Cao, 2012) reportándose proteína total en las diferentes fracciones de sauco (Sambucus nigra) de 21,46% (flor), 30,97% (semilla),
9,33% (tallo), 18,7% (hojas-peciolo) (Carvajal-Salcedo & Cuesta-Peralta, 2016). Igualmente, existe interés en los metabolitos secundarios de estas plantas en especial en
el sauco, debido a que se le han atribuido notables propiedades antioxidantes (Akhtar, Hag & Mirza, 2018) y la capacidad para reducir la emisión de metano (Apráez, Delgado & Narváez, 2018).
Estas especies forrajeras se han usado con mayor frecuencia en sistemas silvopastoriles y bancos de proteína para ser suministrados en fresco; sin embargo, la alta disponibilidad de alimento en época de lluvia debe aprovecharse mediante su preservación por medio de procesos como el ensilaje que se basa en la fermentación de los carbohidratos solubles del forraje por acción microbiana anaerobia, proceso que además reduce su contenido de taninos y fenoles, los cuales pueden tener efectos tóxicos en los animales y afectar la digestibilidad de las proteínas (Wang et al., 2012).
La conservación del alimento a partir del proceso de ensilaje se relaciona con el crecimiento de bacterias ácido lácticas (BAL), que se han utilizado como inoculantes, las cuales fermentan los hidratos de carbono en ácidos orgánicos, particularmente en ácido láctico que acidifica
rápidamente el ensilaje e inhibe el crecimiento de bacterias indeseables (Queiroz, Arriola, Daniel & Adesogan, 2013) de modo que mejoran la fermentación y la estabilidad aeróbica (Daniel et al., 2018) del producto final.
Además, las BAL se han utilizado como probióticos en la alimentación de aves, cerdos y ganado (Rodríguez-
Salgado, Saavedra-Montañez, Fonseca-López & Borrás-
Sandoval, 2019) y se ha demostrado que pueden secuestrar aflatoxinas y micotoxinas (Ma et al., 2017), también reducen las pérdidas volumétricas de materia seca en ensilajes
(Borreani, Tabacco, Schmidt, Holmes & Muck, 2018; Chen & Weinberg, 2014), aunque esto puede variar por factores como la humedad que impacta el proceso de fermentación (Fonseca-López, Saavedra-Montañez & Rodríguez-Molano, 2018), la proporción de inoculante mezclado y la composición química del material a ensilar en donde el contenido de hidratos de carbono solubles, la capacidad buffering (Dong-xia, Kui-kui, Ying-chao, Yan-li & Fu-yu, 2018) y el contenido de azucares (Ni, Yang, Hua, Wang & Pang, 2016) son determinantes.
Por ello, se considera que el factor que más influye en la respuesta de la calidad de los ensilajes es el tipo de forraje (Oliveira et al., 2017). De modo que no siempre es aconsejable la aplicación de inoculantes microbianos, ya que al tratarse de un insumo adicional eleva el costo del ensilaje y resulta ser innecesario cuando el material a ensilar aporta los carbohidratos suficientes para que las bacterias ácido lácticas endófitas prosperen en condiciones de anaerobiosis (Dong-xia et al., 2018). Con base en lo anterior, el objetivo del trabajo fue evaluar el efecto de un inoculante bacteriano sobre la calidad microbiológica y
nutricional de ensilaje a base de morera (Morus alba L.)
y sauco (Sambucus nigra L.) como alimento estratégico en ganaderías ecoeficientes.
Materiales y métodos
Procedimiento de ensilaje. El material vegetal morera (Morus alba L.) y sauco (Sambucus nigra L.) (clasificación hecha por Bravo-P. W. Herbario UPTC) se recolectó de un cultivo establecido en el 2014 en un área de 908,3 m2 con espacio de intersiembra y surco de 1,30 m y 1,50 m, respectivamente, en la Universidad Pedagógica y Tecnológica de Colombia (UPTC), sede Tunja (Boyacá), coordenadas 5° 33’ 7’’ N y 73° 21’ 23’’ W a una altura de 3.000 m.s.n.m. y una temperatura promedio de 13 °C, en donde se realizan podas anuales con tijera (Rodríguez-Molano et al., 2019). Después de cortado el material vegetal, se picó 50 kg de muestra que incluía hojas y tallos en una picapasto marca Indu-tornometal JR® (Funza, Colombia) (Fonseca-López et al., 2018). Luego, el material vegetal se extendió sobre un plástico y se dejó expuesto al sol durante dos horas con volteo cada 30 minutos hasta que no se observó pérdida de efluentes líquidos como único control de humedad.
Se elaboró los ensilajes a pequeña escala (500 g) a partir de la mezcla del 50% de cada material vegetal con cultivo comercial Liofast Y452B, SACCO® (Streptococcus thermophilus y Lactobacillus delbrueckii ssp) (Cadorago, Italia) (Fonseca-López et al., 2018). Este se disolvió en agua (1 g/l) para lograr su distribución homogénea en el ensilaje y se agregó hasta 15% al no observarse pérdida de líquido con presión manual como indicador límite para su inclusión.
El porcentaje de inoculante mezclado fue de 10% (T10) y 15% (T15) y un tratamiento control (T0), de modo que los componentes del T10 fueron 45% de sauco (225 g), 45% de morera (225 g) y 10% de inoculante (50 mL); mientras que en el T15 fueron 42,5% de sauco (212,5 g), 42,5% de morera (212,5 g) y 15% de inoculante (125 mL), con un costo por kilogramo de ensilaje de $ 115 (T10), $ 137,5 (T15) y $ 100 (T0). El manejo se realizó bajo condiciones controladas de llenado en bolsas plásticas de polietileno (calibre 6), compactado manual, tamaño de picado del forraje (3-5 cm) y almacenamiento sobre estibas.
Diseño experimental. El tiempo experimental fue de 28 días y se evaluaron tres tratamientos correspondientes a los diferentes porcentajes de inclusión de inoculante bacteriano (10%, 15%) y un control (0%) en un diseño completamente al azar. Cada tratamiento tuvo 20 repeticiones para un total de 60 unidades experimentales, cada bolsa de ensilaje se trató como unidad experimental.
Variables evaluadas
Análisis composicional. Se determinó la materia seca (MS %) y el contenido de humedad (Hum %) en una estufa de secado marca Memmert® (Karl Kolb, Schwabach, Alemania), cenizas (Cen %) por el método de incineración a 550 °C con mufla Thermolyne® (Dubuque, IA) (Fonseca-López et al., 2018), fibra detergente ácida (FDA %) y fibra detergente neutra (FDN %) por el método Van Soest, Robertson y Lewis (1991) y proteína bruta (PC %) por el método de Kjeldahl (AOAC, 1984). Para realizar los análisis se tomaron cuatro bolsas de ensilaje al azar por tratamiento a los 0, 7, 14, 21 y 28 días, esta frecuencia de análisis difirió para la proteína (0, 14 y 28 días) y las fibras (0 y 28 días ), ya que luego de siete días se logra pH entre 4-4,5 y en este rango se detiene la proteólisis por fermentación (Palacio, Bettucci & Pan, 2016), de modo que frecuencias de análisis más cortas suelen ser innecesarias.
Variación del pH. Se pesó 5 g de ensilaje y se hizo una mezcla homogénea con 45 mL de agua destilada según el método de Elías, Lezcano, Lezcano, Cordero y Quintana (1990), luego se utilizó un potenciómetro OAKTON® (OAKTON Instruments, Vernon Hills, IL, USA) para determinar la variación del pH en las muestras a los 0, 7, 14, 21 y 28 días.
Análisis microbiológico. Con una pipeta Pasteur se tomó 1 mL de la solución descrita anteriormente y
se diluyó hasta 10-9 por el método de dilución en agua destilada. Posteriormente, se depositó una muestra de 1 mL en medios comerciales Compact Dry para E. coliformes, mohos-levaduras y mesófilos® y se incubaron a 37 °C
por 48 horas. Todas las muestras se analizaron en el laboratorio de nutrición animal de la Universidad Pedagógica y Tecnológica de Colombia en Tunja (Fonseca-López & Borras-Sandobal, 2014).
Análisis estadístico. Los datos se organizaron en una hoja Excel, luego con el programa SPSS Statistics se hizo un análisis de varianza y donde hubo diferencias significativas se aplicó la prueba de Tukey (p < 0,05).
Resultados y discusión
Proteína cruda (PC %) y crecimiento bacteriano (UFC.g-1). El contenido de proteína cruda en el sauco llega hasta 21,1% (Apráez et al., 2018) y en las hojas de morera varía de 25,1% a 8%, pero estos valores difieren de acuerdo con la fracción de la planta concentrándose en las semillas seguido de las flores y las hojas (Carvajal-
Salcedo & Cuesta-Peralta, 2016). También influyen la
especie vegetal, condiciones edafoclimáticas, fertilización (Wang et al., 2012), intensificación del cultivo que deriva en pérdida de nutrientes en las hojas (Chakraborty et al., 2016) y el estado de madurez de la planta (Peyrat,
Baumont, Le Morvan & Nozière, 2016). Esto último explica el bajo contenido proteico inicial del material evaluado (plantas de cinco años) que estuvo por encima de 6%. Sin embargo, en el T15 al finalizar el ensayo disminuyó hasta 4,2% (tabla 1), valores similares se han encontrado en microsilos de avena (6,94 ± 0,203%) con fertilización de 90 kg/ha de N (Romero, Zhao, Tiezzi & Castillo, 2017).
La reducción en el contenido de proteína en el T15 se debe a un proceso de heterofermentación con la mayor proliferación de levaduras (12 × 106 UFC.g-1) y enterobacterias (190 × 106 UFC.g-1) (día 28) en comparación con los
tratamientos T0 y T10 que resulta en una fermentación más lenta, deterioro aeróbico y producción de una mezcla de ácido acético y ácido láctico (Ni et al., 2016) por la activación de bacterias latentes que crecen en condiciones favorables; así, las enterobacterias encontradas fueron las cepas que dominaron después de los mesófilos y su presencia no es deseable porque incrementan la producción de ácido acético y crean competencia con las bacterias ácido lácticas (BAL) (Dong-xia et al., 2018). Esta fermentación heteroláctica se relaciona con retrasos en el momento de empaque o en el sellado (Borreani et al., 2018).
Los ensilajes de T0 y T10 presentaron la mejor calidad proteica (6%), pero este valor es bajo por tratarse de material ensilado de poda anual de plantas que tenían cinco
años de edad (Rodríguez-Molano et al., 2019), debido
a que el estado de madurez tiene una correlación negativa con el contenido proteico del material vegetal (Peyrat et al., 2016), y puede ir acompañado de la disminución en la proporción de hojas-tallos lo que, a su vez, pudo influir en los resultados; por ejemplo, en sauco la proteína en los tallos es menor (9,33%) en comparación con la fracción de hojas-peciolo (18,7%) (Carvajal-Salcedo & Cuesta-Peralta, 2016). Sin embargo, la mejor calidad proteica en T0 y T15 se debió posiblemente por una fermentación más estable, lo que indica que estos tuvieron condiciones de temperatura, disponibilidad de azúcares y un grado de anaerobiosis que favoreció la tasa de crecimiento de BAL (Borreani et al., 2018).
Por otro lado, aunque en ensilajes de morera no se han encontrado cepas BAL de alta capacidad fermentativa propias del cultivo que se supondría pueden colonizar
fácilmente la planta para ser utilizados como inoculantes
(Ni et al., 2016), un ambiente anaerobio garantiza que aquellas BAL endófitas se reproduzcan y ganen por competencia a los microorganismos indeseables, tal como se observó en el T0, y una vez crean un ambiente ácido por el agotamiento de carbohidratos que son usados en sus procesos metabólicos disminuyen su crecimiento (Fonseca-
López et al., 2018). Es de destacar que el mayor número de UFC de BAL también favorece ambientes anaerobios debido a que algunas pueden consumir el oxígeno molecular
desde el sellado, al igual que el tejido de la planta que continúa activo después del picado (Borreani et al., 2018).
Humedad (Hum %). El contenido de humedad de la hoja (CHH) y la capacidad de retención de humedad (CRH) son los dos factores importantes que mantienen los niveles nutritivos de las hojas y mejoran su palatabilidad (Chakraborty et al., 2016). Sin embargo, un alto contenido de humedad en los materiales forrajeros que se van a ensilar afecta el proceso de fermentación, debido a que alta cantidad de agua permite el mayor crecimiento de microorganismos (Fonseca-López & Borras-Sandoval, 2014) y altera la tasa de degradación del ensilaje (Zou et al., 2016). En morera, los valores de humedad van hasta 79,91% en hojas jóvenes con proteína de 26,63 mg/g (Chakraborty et al., 2016), pero esta se reduce con la edad de las plantas y condiciones ambientales, mientras que en follaje completo de sauco se reporta 77,41% de humedad (22,59% MS) en árboles con un periodo vegetativo de 90 días (Carvajal-Salcedo & Cuesta-Peralta, 2016). En este trabajo, para disminuir la humedad del material vegetal se realizó secado al aire libre para evaporar los efluentes líquidos generados en el proceso de elaboración, pero siete días después del sellado la humedad en los ensilajes se incrementó con el paso del tiempo hasta el día 21 y, posteriormente, hubo una reducción numérica no significativa (día 28) en T0 y T15 (p > 0,05) (tabla 2).
La marcada diferencia en la humedad con el paso del tiempo y su tendencia a aumentar se asocia con la producción de agua en los procesos metabólicos y por la formación de
enlaces peptídicos, en los que se pierde una molécula
de agua por enlace formado (Fonseca-López et al., 2018), pero también, con la descomposición de proteínas cuando se observa su disminución, como en este trabajo, donde la pérdida de proteína fue de 2,1 unidades en T15 (4,2% PC) respecto a T0 (6% PC) y T10 (6% PC) y dicho tratamiento corresponde al ensilaje con mayor humedad al final de la evaluación. Aunque la pérdida de materia seca también se relaciona con la presencia de oxígeno en procesos de ensilado que van acompañados por pH elevados y deterioro del material (Borreani et al., 2018).
Materia seca (MS). El sauco puede llegar a contener 19,6 % de MS (Apráez et al., 2018) y la morera hasta 20,09% MS (Chakraborty et al., 2016), aunque estos valores cambian por el periodo vegetativo y fracción de la planta (Carvajal-Salcedo & Cuesta-Peralta, 2016). Cuando se mezclaron en proporción 50:50, el contenido de MS inicial estuvo por encima del 50% en todos los tratamientos, sin existir diferencias significativas por punto de muestreo (p > 0,05) (tabla 3); lo que muestra que el tratamiento de secado al aire libre que se realizó previo a embolsar los ensilajes fue homogéneo en todos los tratamientos. Estos valores que son más altos a lo reportado en ensilaje de maíz (33,6% - 37,7%) (Ebling & Kung, 2004) y ensilaje de avena (42,95 ± 0,93%) (Romero et
al., 2017). Sin embargo, con el tiempo hubo una reducción volumétrica de 10,89% (T0), 10,26% (T10) y 13,57% (T15) al finalizar la evaluación con respecto el contenido de MS inicial (tabla 4).
Esta pérdida de MS en la fermentación proviene principalmente de la producción de dióxido de carbono por los microorganismos presentes en el sustrato que usan
azúcares en su metabolismo como la glucosa, citrato o malato,
de modo que BAL-heterofermentativas generan 1 mol de dióxido de carbono por mol de glucosa consumida, lo que lleva a una pérdida del 24% MS y pérdida del 1,7% de la energía bruta en el ensilaje (Borreani et al., 2018). Esto indica que la MS en el ensilaje es afectada por el tipo de población bacteriana presente tal como se observó en los tratamientos, en donde el T15 al finalizar el ensayo obtuvo menor contenido de MS y mayor crecimiento de enterobacterias y levaduras, las cuales son capaces de generar por cada mol de glucosa consumida pérdidas de 17% y 48,9% de MS, respectivamente (Borreani et al., 2018).
Contrario a nuestros resultados, la inoculación de BAL ha mejorado la recuperación de MS en pastos templados y tropicales pero no en el maíz y en el sorgo (Oliveira et al., 2017). Este mismo comportamiento se reporta en otro ensayo donde se usó una cepa ácido láctica (Lactobacillus plantarum) (106 UFC/g) en ensilaje de trigo y se observó mayor producción de dióxido de carbono, deterioro aeróbico más intenso y producción de ácido acético de 8-15 g/kg MS; sin embargo, no hubo pérdidas en el contenido de ceniza, MS y digestibilidad (Chen & Weinberg, 2014).
Por otro lado, los ensilajes del T0 tuvieron menos pérdidas volumétricas, esto puede indicar que los microorganismos epífitos de los materiales evaluados lograron mantener una fermentación más estable y, en consecuencia,
hay menor pérdida de MS (T0) a pesar de no existir diferencias significativas (p > 0,05) pero sí numéricas entre los tratamientos (28 días), de modo que la efectividad del inoculante BAL aplicado puede variar por el sustrato y como en este caso su aplicación no siempre permite obtener mayor contenido de MS en los ensilajes.
Cenizas (Cen %). El sauco puede aportar 10,2% de cenizas (Apráez et al., 2018) y la morera 8,6% (Fonseca-López et al., 2018) o más, valores cercanos a los obtenidos en los ensilajes en donde se observó su disminución en relación con el tiempo existiendo diferencias significativas únicamente el día 21 (p < 0,05) (tabla 5).
Este parámetro suele ser usado para estimar el deterioro de los ensilajes y la variación de la MS bajo la suposición que si la materia orgánica se consume debe permanecer el
contenido de cenizas constante; así, un incremento en
el contenido de cenizas indica pérdida de MS en el ensilaje (Ashbell & Weinberg, 1992). Sin embargo, aunque sí hubo pérdidas volumétricas se observó una disminución en el contenido de cenizas, lo que se atribuye al uso de minerales como P, Ca, Mg, Fe y S en la formación de estructuras
bacterianas y su intervención como cofactores en los procesos metabólicos (Fonseca-López et al., 2018), pero no se relaciona con la pérdida de MS.
pH. La aplicación del inoculante bacteriano redujo el pH inicial de los ensilajes T10 (4,57 ± 0,14) y T15 (4,53 ± 0,21) frente al control T0 (6,14 ± 0,11), posteriormente disminuyó en 0,0553 unidades (T0), 0,008 unidades (T10) y 0,0163 (T15) con intervalos de siete días (figura 1) y al finalizar el ensayo el pH más alto lo obtuvo el T10 (4,32 ± 0,02) seguido de T0 (4,09 ± 0,06) y el T15 (4,02 ± 0,03) (p < 0,05) con diferencias significativas los días 0, 21 y
28 (p < 0,05).
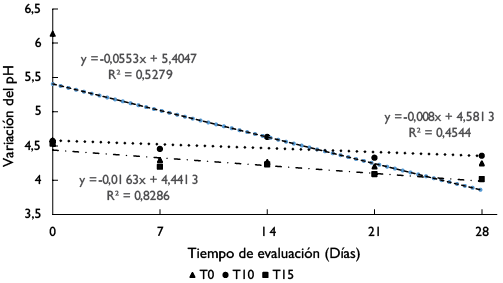
Figura 1. Variación del pH de los ensilajes durante 28 días de evaluación
El pH de los ensilajes analizados se acercó a 4 a partir del día siete, aunque se ha observado que al tercer día puede estar por debajo de dicho valor (Queiroz et al., 2013) como en ensilajes de maíz (3,67 y 3,8) (Weiss, Kroschewski & Auerbach, 2016). Un pH de 4 se considera
adecuado para que las actividades metabólicas se detengan y el forraje se conserve (Mbatha & Bakare, 2018),
aunque puede estar en 4,2 (Chen & Weinberg, 2014) y 4,25 (Romero et al., 2017) logrando mantener un buen estado, pero, en general, el rango óptimo está entre 4-4,5 (Palacio et al., 2016).
La reducción en el pH se relaciona con la acumulación de ácido láctico, pero su incremento se debe al crecimiento de organismos aerobios que, a su vez, aumentan la temperatura del ensilaje y pueden deteriorar los valores nutritivos hasta en 16% (Borreani et al., 2018).
Los ensilajes de T15 obtuvieron el pH más bajo y el mayor contenido de levaduras y enterobacterias debido a que estos microorganismos crecen a pH inferiores y empiezan a utilizar el lactato para reducir la acidez del medio (Borreani
et al., 2018). Sin embargo, para evitar alto crecimiento de levaduras pueden utilizarse aditivos como el benzoato que tiene propiedades antimicóticas (0,1%) (Queiroz et al., 2013), bacteriocina para el control de Enterococcus faecium (Amado, Fuciños, Fajardo & Pastrana, 2016) y el ácido propiónico para prevenir e inhibir el crecimiento de E. coli y otras enterobacterias (Ogunade et al., 2016).
Fibra detergente ácida (FDA) y fibra detergente neutra (FDN). El contenido de FDN en las hojas de
especies arbustivas y arbóreas varía por especie, en morera se ha encontrado valores de 27,8% (Morus atropurpurea Roxb), 26,2% (Morus atropurpurea Roxb), 27,5% (Morus multicaulis Perr) a los 60 días de corte (Wang et al., 2012). Y en el sauco (Sambucus nigra) 23,4% a los 90 días (Apráez et al., 2018). Valores que son inferiores a los observados en especies como alfalfa (Medicago sativa) a los 60 días de poda (35%), acacia negra (Acacia decurrens) a los 90 días
(36,6%), rábano forrajero (Raphanus sativus) a los 35
días (52,4%), y altamisa (Ambrosia arborescens) a los 60 días (44,9%) (Apráez et al., 2018).
En este trabajo se observó que no hubo cambios marcados en la FDA (tabla 6) y la FDN (tabla 7) de los ensilajes, con diferencias significativas para la FDA únicamente en el T15 al finalizar el ensayo (28 días)(p < 0,05) (tabla 6). El comportamiento general fue de incremento de la FDA, lo que se relaciona con un mayor consumo de los carbohidratos en comparación con las paredes celulares durante el proceso de fermentación.
Este mismo se observó en la FDN de los ensilajes (tabla 7), que fue mayor a lo reportado en morera 16,4% (Morus atropurpurea Roxb), 17% (Morus atropurpurea Roxb), 17,6% (Morus multicaulis Perr) (Wang et al., 2012) y sauco 33,2% (Apráez et al., 2018). Lo que se asocia con la edad de las plantas, de modo que el contenido de fibra en los ensilajes no difirió con la aplicación de inoculante microbiano; esto mismo se ha obtenido con la aplicación simultánea de
Lactobacillus y celulosa en ensilajes de alfalfa y se atribuye a las cepas utilizadas, temperatura y pH de los ensilajes (Dong-xia et al., 2018). Sin embargo, con la inoculación de BAL se ha reducido la concentración de lignina, aunque la concentración de FDA y FDN permanezcan constantes (Oliveira et al., 2017).
Conclusiones
El uso de inoculantes bacterianos con Lactobacillus no siempre mejoran el contenido de proteína en los ensilajes ni reducen las pérdidas de materia seca; por ello, antes de ser utilizados debe corroborarse su efectividad, ya que pueden impactar el rendimiento volumétrico de la
materia seca hasta en 13,57% por favorecer el crecimiento de BAL heterofermentativas, levaduras y enterobacterias que consumen los carbohidratos, los minerales y degradan las proteínas hasta en 2,1 unidades, proceso en el que hay incremento en la humedad que favorece la putrefacción del alimento. Se concluye que en ensilaje de morera (Morus alba) y sauco (Sambucus nigra L.) (50:50) cuando se logra condiciones de anaerobiosis y humedad inicial de 48,31%, no es necesario aplicar inoculantes
bacterianos, ya que las bacterias ácido lácticas endófitas del material logran crecer en mayor proporción que levaduras y enterobacterias.
Reconocimientos
Los autores agradecen al grupo de investigación en
Bioquímica y Nutrición Animal (GIBNA) por facilitar el procesamiento de las muestras en el Laboratorio de
Nutrición Animal de la Universidad Pedagógica y Tecnológica de Colombia, y a los semilleros por el apoyo en el trabajo de campo.
El artículo es resultado de la investigación “Elaboración de ensilajes para bovinos a partir de especies arbustivas” Universidad Pedagógica y Tecnológica de Colombia, Año 2018.
Referencias
Akhtar, N., Hag, I., & Mirza, B. (2018). Phytochemical analysis and comprehensive evaluation of antimicrobial and antioxidant properties of 61 medicinal plant species. Arabian Journal of Chemistry, 11(8), 1223-1235. http://dx.doi.org/10.1016/j.arabjc.2015.01.013
Amado, I. R., Fuciños, C., Fajardo, P., & Pastrana, L. (2016). Pediocin SA-1: A selective bacteriocin for controlling Listeria monocytogenes in maize silages. Journal of Dairy Science, 99(10), 8070-8080. http://dx.doi.org/10.3168/jds.2016-11121
AOAC. (1984). Official methods of analysis. Kjeldahl method. 14th edition. Washington D. C.
Apráez, J. E., Delgado, J. M., & Narváez, J. (2018). Composición nutricional, degradación in vitro y potencial de producción de gas, de herbáceas, arbóreas y arbustivas encontradas en el trópico alto de Nariño. Livestock Research for Rural Development, 24(3). http://www.lrrd.org/lrrd24/3/apra24044.htm
Ashbell, G., & Weinberg, Z. G. (1992). Top silage losses in horizontal silos. Canadian Agricultural Engineering, 34(2), 171-175.
Borreani, G., Tabacco, E., Schmidt, R. J., Holmes, B. J., & Muck, R. E. (2018). Silage review: Factors affecting dry matter and quality losses in silages. Journal of Dairy Science, 101(5), 3952-3979. http://dx.doi.org/10.3168/jds.2017-13837
Carvajal-Salcedo, T., & Cuesta-Peralta, A. (2016). Conservación y composición nutricional del follaje de sauco (Sambucus nigra). Pastos y Forrajes, 39(2), 125-132.
Chakraborty, B., Kundu, M., & Chattopadhyay, R. N. (2016). Organic farming with Bio-mulching– a new paradigm for sustainable leaf yield & amp; quality of mulberry (Morus Alba L.) under rainfed lateritic soil condition. Agriculture and Agricultural Science Procedia, 11, 31-37. http://doi.org/10.1016/j.aaspro.2016.12.006
Chen, Y., & Weinberg, Z. G. (2014). The effect of relocation of whole-crop wheat and corn silages on their quality. Journal of Dairy Science, 97(1), 406-410. http://dx.doi.org/10.3168/jds.2013-7098
Daniel, J. L. P., Queiroz, O. C. M., Arriola, K. G., Daetz, R., Basso, F., Romero, J. J., & Adesogan, A. T. (2018). Effects of homolactic bacterial inoculant on the performance of lactating dairy cows. Journal of Dairy Science, 101(6), 5145-5152. http://dx.doi.org/10.3168/jds.2017-13880
Dong-xia, L. I., Kui-kui, N. I., Ying-chao, Z., Yan-li, L. I. N., & Fu-yu, Y. (2018). Influence of lactic acid bacteria, cellulase, cellulase-producing Bacillus pumilus and their combinations on alfalfa silage quality. Journal of Integrative Agriculture, 17(12), 2768-2782. http://dx.doi.org/10.1016/S2095-3119(18)62060-X
Ebling, T. L., & Kung, L. (2004). A Comparison of processed conventional corn silage to unprocessed and processed brown midrib corn silage on intake, digestion, and milk production by dairy cows. Journal of Dairy Science, 87(8), 2519-2526. http://dx.doi.org/10.3168/jds.S0022-0302(04)73376-7
Elías, A., Lezcano, O., Lezcano, P., Cordero, J., & Quintana, L. (1990). Reseña descriptiva sobre el desarrollo de una tecnología de enriquecimiento proteínico en la caña de azúcar mediante fermentación solida (Saccharina). Revista Cubana de Ciencia Agrícola, 24(1), 1-12.
Fonseca-López, D., & Borras-Sandoval, L. (2014). Evaluation effect of fresh potatoes included in a food based meal, on production and milk quality in Holstein cows. Ciencia y Agricultura, 11(1), 55-65. http://dx.doi.org/10.19053/01228420.3488
Fonseca-López, D., Saavedra-Montañéz, G., & Rodríguez-Molano, C. E. (2018). Elaboración de un alimento para ganado bovino a base de zanahoria (Daucus carota L.) mediante fermentación en estado sólido como una alternativa ecoeficiente. Revista Colombiana de Ciencias Hortícolas, 12(1), 175-182. http://dx.doi.org/10.17584/rcch.2018v12i1.7416
Ma, Z. X., Amaro, F. X., Romero, J. J., Pereira, O. G., Jeong, K. C., & Adesogan, A. T. (2017). The capacity of silage inoculant bacteria to bind aflatoxin B1 in vitro and in artificially contaminated corn silage. Journal of Dairy Science, 100, 7198-7210. http://dx.doi.org/10.3168/jds.2016-12370
Mbatha, K. R., & Bakare, A. G. (2018). Browse silage as potential feed for captive wild ungulates in southern Africa: A review. Animal Nutrition, 4(1), 1-10. http://dx.doi.org/10.1016/j.aninu.2017.12.003
Ni, K. kui, Yang, H. xiao, Hua, W., Wang, Y. Ping, & Pang, H. li. (2016). Selection and characterisation of lactic acid bacteria isolated from different origins for ensiling Robinia pseudoacacia and Morus alba L. leaves. Journal of Integrative Agriculture, 15(10), 2353-2362. http://dx.doi.org/10.1016/S2095-3119(15)61251-5
Ogunade, I. M., Kim, D. H., Jiang, Y., Weinberg, Z. G., Jeong, K. C., & Adesogan, A. T. (2016). Control of Escherichia coli O157: H7 in contaminated alfalfa silage: effects of silage additives. Journal of Dairy Science, 99(6), 4427-4436. http://dx.doi.org/10.3168/jds.2015-10766
Oliveira, A. S., Weinberg, Z. G., Ogunade, I. M., Cervantes, A. A., Arriola, K. G., Jiang, Y., Kim, D., Li, X., Gonçalves, M. C., Vyas, D., Adesogan, A. T. (2017). Meta-analysis of effects of inoculation with homofermentative and facultative heterofermentative lactic acid bacteria on silage fermentation, aerobic stability, and the performance of dairy cows. Journal of Dairy Science, 100(6), 4587-4603. http://dx.doi.org/10.3168/jds.2016-11815
Palacio, A., Bettucci, L., & Pan, D. (2016). Fusarium and Aspergillus mycotoxins contaminating wheat silage for dairy cattle feeding in Uruguay. Brazilian Journal of Microbiology, 47(4), 1000-1005. http://dx.doi.org/10.1016/j.bjm.2016.06.004
Peyrat, J., Baumont, R., Le Morvan, A., & Nozière, P. (2016). Effect of maturity and hybrid on ruminal and intestinal digestion of corn silage in dry cows. Journal of Dairy Science, 99(1), 258-268. http://dx.doi.org/10.3168/jds.2015-9466
Queiroz, O. C. M., Arriola, K. G., Daniel, J. L. P., & Adesogan, A. T. (2013). Effects of 8 chemical and bacterial additives on the quality of corn silage. Journal of Dairy Science, 96(9), 5836-5843. http://dx.doi.org/10.3168/jds.2013-6691
Rodríguez-Salgado, A. M, Saavedra-Montañez, G. F., Fonseca-López, D., Borrás-Sandoval, L. M. (2019). Características de algunos preparados microbianos sobre el desarrollo biotecnológico en el sector agropecuario. Infometric@-Serie Ingeniería, Básicas y Agrícolas, 2(1), 39-50. http://cienciometrica.com/infometrica/index.php/syh /article/view/65/64.
Rodríguez-Molano, C., Fonseca-López, D., Niño-Monroy, L. E., Salamanca-López, A. E., Hoyos-Concha, J. L., & Otero-Ramírez, I. D. (2019). Caracterización nutricional y de producción de biomasa de Sambucus peruviana, Sambucus nigra y Morus alba en un banco forrajero. Ciencia en Desarrollo, 10(2). http://dx.doi.org/10.19053/01217488.v10.n2.2019.9098
Romero, J. J., Zhao, Y., Tiezzi, F., & Castillo, M. S. (2017). Laboratory silo type and inoculation effects on nutritional composition, fermentation, and bacterial and fungal communities of oat silage. Journal of Dairy Science, 100(3), 1812-1828. http://dx.doi.org/10.3168/jds.2016-11642
Van Soest, P. J., Robertson, J. B., & Lewis, B. A. (1991). Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition. Journal of Dairy Science, 74(1), 3583-3597. http://dx.doi.org/10.3168/jds.S0022-0302(91)78551-2
Wang, W. X., Yang, H. J., Bo, Y. K., Ding, S., & Cao, B. H. (2012). Nutrient composition, polyphenolic contents, and in situ protein degradation kinetics of leaves from three mulberry species. Livestock Science, 146(2-3), 203-206. http://dx.doi.org/10.1016/j.livsci.2012.03.009
Weiss, K., Kroschewski, B., & Auerbach, H. (2016). Effects of air exposure, temperature and additives on fermentation characteristics, yeast count, aerobic stability and volatile organic compounds in corn silage. Journal of Dairy Science, 99(10), 8053-8069. http://dx.doi.org/10.3168/jds.2015-10323
Zou, Y., Dong, S., Du, Y., Li, S., Wang, Y., & Cao, Z. (2016). Effects of moisture content or particle size on the in situ degradability of maize silage and alfalfa haylage in lactating dairy cows. Animal Nutrition, 2(3), 249-252. http://dx.doi.org/10.1016/j.aninu.2016.05.002
