La radioactividad ambiental*
Environmental radioactivity
Radioactividad ambiental
* Artículo de divulgación científica.
** Catedrático Emérito de Física Nuclear. Facultad de Ciencias. Universidad de Zaragoza, España. Correo electrónico: nlagos@unizar.es
Copyright: Esta revista provee acceso libre inmediato a su contenido bajo el principio de que hacer disponible gratuitamente investigación al publico apoya a un mayor intercambio de conocimiento global. Esto significa que se permite la copia y distribución de sus contenidos científicos por cualquier medio siempre que mantenga el reconocimiento de sus autores, no haga uso comercial de las obras y no se realicen modificaciones de ellas.

RESUMEN
Se explican los conceptos fundamentales relacionados con la radiactividad y se utilizan para describir la radiactividad ambiental. Se explican también los isótopos de largo periodo y las principales familias radioactivas junto con la radiación cósmica y los radionucleidos cosmogénicos.
Palabras clave: Radioactividad, desintegraciones nucleares, radiaciones ionizantes, dosis, medio ambiente
ABSTRACT
The fundamental concepts involved in radioactivity are explained and used to describe the environmental radioactivity. Long life radioisotopes and main radioactive natural families are explained together with cosmic radiation and cosmogenic radionuclides.
Key words: Radioactivity, Nuclear Decay, Ionizing Radiation, Dose, Environment
RESUMO
Explicam-se os conceitos fundamentais relacionados à radioatividade e utilizam-se para descrever a radioatividade ambiental. Se explica também os isótopos de longo período e as principais famílias radioativas juntamente com a radiação cósmica e os radionuclídeos cosmogênicos.
Palavras-chave: Radioatividade, desintegrações nucleares, radiações ionizantes, dose, meio ambiente.
INTRODUCCIÓN
Conceptos fundamentales La radiactividad es un fenómeno natural que consiste en la emisión espontánea de partículas y/o radiación electromagnética por un núcleo. Como consecuencia, el núcleo original, núcleo padre, se transmuta por lo general en otro núcleo distinto, núcleo hijo.
La radiactividad fue descubierta por Henry Becquerel en 1895, no fue una invención humana, la radiactividad existía y existe de forma natural pero no se había detectado hasta entonces. Los seres humanos no están dotados de ningún órgano ni sentido capaz de detectar o sentir la radioactividad, se necesita para ello un equipo de detección. El efecto que tiene la radiactividad sobre cualquier materia es ionizar los átomos con que se encuentra en su camino, es pues una radiación ionizante .
Se conoce como Actividad al número de núcleos que se desintegran en la unidad de tiempo, su unidad, el Becquerelio, es 1Bq = 1 desintegración/segundo. No se sabe cuándo se va a desintegrar un radionucleido y emitir radioactividad. El tiempo necesario para que el número de núcleos radioactivos presentes en una determinada cantidad de sustancia se reduzca a la mitad se conoce como Periodo o semivida, T1/2, que no debe confundirse con vida media que es el tiempo necesario para que el número de núcleos se reduzca e veces. El periodo de un radionucleido es una característica intrínseca del núcleo que no se puede variar por ningún medio, incluso en los interiores estelares se sigue manteniendo.
Los periodos de los radionucleidos varían desde unos nanosegundos a miles de millones de años. Se conoce como Dosis Absorbida la cantidad de energía que una radiación, de cualquier tipo, deposita en la unidad de masa, su unidad es el Gray definido por 1Gy = 1 Julio/1 kg. El efecto biológico de 1 G y depende del tipo de radiación ionizante que lo produce y para tener en cuenta este hecho se define para ser humano la Dosis Equivalente con la unidad Sievert, 1 Sv = 1 Gy x wR, donde wR es un factor de peso que tiene en cuenta el efecto sobre el ser humano.
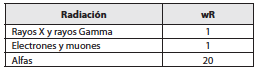
En la tabla 1 se pueden ver algunos de sus valores para radiaciones medioambientales:
Tabla No . 1 . Factores de peso para distintas radiaciones ionizantes existentes en la radiactividad ambiental
Se ve claramente la gran peligrosidad de la radiación alfa. Afortunadamente esta radiación se absorbe al atravesar pequeñísimos espesores de materia y un simple papel o unos centímetros de aire la absorben por completo por lo que en el medio ambiente es prácticamente inocua, sin embargo es muy peligrosa si el radionucleido padre es ingerido o inhalado.
1 . TIPOS DE RADIACTIVIDAD
La radiactividad que emiten los núcleos puede ser de tres tipos que, al desconocer su naturaleza, recibieron el nombre de alfa, beta y gamma. La radiactividad alfa consiste en la emisión por un radionucleido de un núcleo de Helio, 2He4 o partícula alfa. Este núcleo es uno de los más estables de la naturaleza, está formado por dos protones y dos neutrones y en el interior de ciertos núcleos pesados tiene una cierta probabilidad de formarse y ser emitido. El núcleo hijo tiene 2 protones y 2 neutrones menos, es decir 4 nucleones menos. La radiactividad beta , β–, es la emisión por un núcleo de un electrón, que puede ser negativo o positivo. El electrón positivo se conoce también como positrón y se habla entonces de emisión beta positiva o beta +, β+. En la emisión beta negativa se convierte un neutrón en un protón, no varía el número de nucleones y se emite un electrón. En la desintegración beta+ es un protón el que se convierte en un neutrón y se emite un positrón.
En ciertos núcleos existe el proceso de captura electrónica, CE, que tiene los mismos efectos de transmutación que la emisión beta+ pero no se emite un positrón. El núcleo captura un electrón de la corteza atómica y uno de sus protones se transforma en un neutrón.
Este proceso es energéticamente más favorable que le emisión β+. Después de un proceso de emisión alfa o beta el núcleo resultante se encuentra por lo general en un estado excitado y vuelve a la situación estable emitiendo uno o varios fotones, que no son más que los cuantos de radiación electromagnética, esta emisión electromagnética se conoce como radiación gamma . La radiactividad gamma suele, por tanto, acompañar a la radiactividad alfa o beta y no altera la naturaleza del núcleo que la emite.
2 . RADIACTIVIDAD AMBIENTAL
En el medio ambiente que nos rodea, aire, agua, suelos se encuentra una multitud de radionucleidos que están emitiendo su radiactividad y son una componente importante de la radiactividad ambiental. En muchos casos sus hijos también son radioactivos y se originan largas familias de radionucleidos que más adelante veremos.
Pero estas fuentes no son las únicas existentes en nuestro medio ambiente, nuestro planeta está sometido a un bombardeo constante de partículas procedentes del espacio exterior que se conoce como radiación cósmica . Esencialmente se trata de protones muy energéticos que en la alta atmosfera interaccionan con los núcleos de aire originando otros radionucleidos y grandes cantidades de partículas que al final alcanzan la superficie terrestre. La radiación cósmica es una fuente ionizante y además en su paso por la atmósfera un productor de radionucleidos. A estos radionucleidos cosmogénicos hay que añadir en el medio ambiente los artificiales creados por el hombre.
Los radionucleidos naturales
Los radionucleidos naturales actuales proceden de los que existieron en el momento de la formación de la tierra. Hoy día se han detectado 15 especies de radionucleidos primordiales, pero, con la mejora de la sensibilidad de los métodos de detección, es posible que se puedan encontrar trazas de algunos más. Sus periodos varían entre los 704 millones de años del 92U235 a los 1016 años del 62Sm149. Su actividad es, en todos los casos, muy pequeña y por tanto son muy difíciles de detectar y medir.
De todos los radionucleidos naturales cuatro son de especial relevancia porque se encuentran repartidos muy uniformemente por todo el planeta. Se trata de dos isótopos del Uranio y el Torio que originan familias radiactivas muy largas y del Potasio que forma parte de la sal del agua marina y de todos los seres vivos. Prácticamente, es imposible encontrar en la tierra un material o un ambiente que no sea radioactivo, todos lo son en mayor o menor grado incluso nosotros mismos.
Las tres familias radiactivas existentes en la tierra tienen su origen actual en el 92U235, el 92U238 y el 90Th232, que son los elementos de largo periodo que permanecen hoy día procedentes de unos progenitores que se generaron en la gran explosión de la estrella que dio origen a nuestro sol y a todo el sistema solar. Todos ellos han desaparecido pero en sus largas familias estos tres todavía no han llegado a extinguirse.
En promedio hay 5 partes por millón de Uranio en la corteza terrestre y las reservas conocidas que contienen una concentración superior a 1 kg por tonelada se calcula que albergan unos 5 millones de toneladas. Las estimaciones más optimistas aumentan estas reservas en un factor 3 ó 4. En los océanos la acumulación de Uranio se estima en unos 4.000 millones de toneladas aunque su posible explotación no está a la vista dada su extrema dilución. La radiactividad de 1 gramo de Uranio en equilibrio con sus descendientes libera una potencia de 0,95 erg./s. La fisión de un gramo de 92U235 produce en cambio 8,21x1017 ergios.
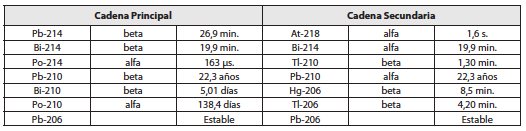
El Uranio natural actual es una mezcla de dos isótopos que primordialmente eran igualmente abundantes. El 0,72% es 92U235 que tiene un periodo de 704 millones de años y el 99,28% restante es 92U238 que vive 4.460 millones de años. Ambos originan familias radiactivas que están detalladas en las tablas 2 y 3.
Tabla No . 2 . Familia radiactiva del 92U235
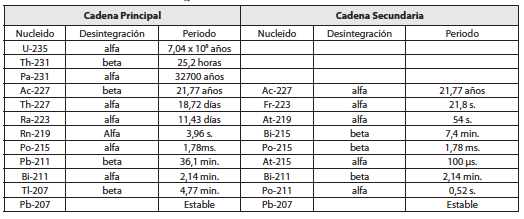
El 92U235 es fisible, de ahí la importancia estratégica del Uranio. Hay un isótopo, producido artificialmente a partir del Torio como veremos más adelante, el 92U233 que también es un buen combustible nuclear.
En el organismo humano el Uranio se encuentra principalmente concentrado en el cerebro y en el corazón. La cantidad total que contiene un ser humano es de unos 100 microgramos aunque varía de unos individuos a otros según
su alimentación, o más precisamente, varía con la composición del suelo y los fertilizantes usados en la producción de los alimentos agrícolas que las personas consumen. Algunos fertilizantes químicos contienen cantidades apreciables de Uranio proveniente de los fosfatos utilizados en su fabricación. Desde el punto de vista de la radiactividad natural, dada su escasa abundancia, el 92U235 y sus descendientes juegan un papel muy poco importante frente al que desempeñan el 92U238 y los suyos.
Tabla No . 3 . Familia radiactiva del 92U238
Entre los descendientes del 92U238 se encuentran dos nucleidos de especial importancia para la humanidad el 88Ra226 y el 86Rn222. El radio fue el descubierto por el Matrimonio Curie y es el único isótopo, de los 16 que se conocen, que tiene larga vida, su periodo es de 1.600 años. Hasta el advenimiento de la energía nuclear, el Uranio se extraía fundamentalmente para la producción de radio para usos médicos y de investigación. Durante toda la primera mitad del siglo pasado tan solo se habían extraído unos pocos kilogramos 88Ra226 y es sorprendente que, tan pequeña cantidad de un elemento químico, causase el enorme impacto que produjo en multitud de campos y actividades de la humanidad.
El radio se encuentra prácticamente en todas las rocas, suelos y aguas de cualquier origen. Químicamente es similar al Calcio por lo que es absorbido por las plantas y transferido al organismo humano y animal a través de la cadena alimentaria. En promedio la radiactividad que un ser humano produce debida a su contenido en radio y sus descendientes es 1 Bq, es decir una desintegración por segundo.
El 88Ra226 es radiactivo alfa y ha servido hasta muy recientemente para definir la unidad de actividad radiactiva puesto que 1 g. de Radio tiene una actividad de 1 Curio, Ci. 1Ci = 3,7x1010Bq. Su hijo es el 86Rn222, un gas noble, radiactivo alfa, con un periodo de 3.8 días, que hasta muy recientemente no se ha tenido apenas en cuenta desde el punto de vista ambiental. No existe en nuestro planeta un lugar en el que no exista Radón.
Como gas químicamente inerte escapa con facilidad del lugar de su nacimiento y se difunde por la atmósfera. Como su padre, el 88Ra226 es soluble, móvil y se encuentra uniformemente repartido por toda la corteza terrestre pues se origina en prácticamente todos los lugares. En nuestra vida ordinaria el Radón se encuentra en el aire que respiramos y es emanado por la tierra, los materiales de construcción y las aguas. Los lugares poco ventilados pueden llegar a tener importantes concentraciones de Radón en el aire y convertirse en un peligro para la salud, sobre todo si sus paredes son ricas en Uranio. En las grietas que se forman en los terremotos y en las erupciones volcánicas suele tener lugar una liberación importante del Radón retenido entre las rocas. En la erupción del volcán Santa Elena, en 1980 en los Estados Unidos, se estima que se liberaron 1,1x1017 Bq en forma de Radón.
Las zonas graníticas y los edificios basados en este material producen más Radón que los construidos con otros materiales. El gas penetra en el organismo humano a través de dos caminos bastante eficientes y peligrosos, el aire que respiramos y el agua que bebemos. El Radón en sí mismo es químicamente inocuo y se expulsa de nuevo con facilidad pero su desintegración es alfa y por tanto muy peligrosa y sus productos de desintegración son sólidos y de vida corta. Entre ellos el 84Po210 es especialmente perjudicial por ser a su vez, también, un emisor de partículas alfa bastante energéticas. En los cigarrillos se encuentra, para desgracia de los fumadores, este radionucleido.
El Torio debe su nombre al Dios escandinavo Thor, Dios de la guerra, nombre que le impuso su descubridor el científico Sueco Berzelius en 1828. El Torio natural es un isótopo único, el 90Th232. Hoy día se conocen 12 isótopos radiactivos del Torio pero son de vida relativamente corta. Es un elemento con un comportamiento geológico y una distribución en nuestro planeta muy similar al Uranio aunque es mucho más abundante, casi tres veces más. En promedio, la concentración de Torio en la corteza terrestre es de algo más de una parte por cien mil.
Se conocen varios depósitos importantes de mineral, en Brasil y la India, aunque están prácticamente sin explotar. Su mayor utilización, hasta ahora, se ha limitado a la fabricación de las mallas incandescentes de las lámparas de gas, hoy día en desuso, electrodos para soldadura de alta precisión, soldadura TIG, y para fabricar filamentos de alta temperatura y emisividad utilizados en lámparas de descarga y magnetrones de hornos microondas. Las reservas conocidas se estiman en una cantidad similar a la existente de Plomo. El Torio no es un elemento fisible pero a partir de él, por bombardeo de neutrones, se puede producir el 92U233 que es un excelente combustible nuclear. Hoy día ya existen reactores nucleares de investigación basados en este combustible que no produce transuránidos y por tanto es mucho más limpio y menos peligroso.
La familia del Torio contiene un buen número de elementos radiactivos cuyas características principales se encuentran en la Tabla 4. Entre los descendientes del Torio también se encuentra un isótopo del radio, el 88Ra224, no utilizable en la práctica puesto que su periodo es de tan solo de 3,66 días. Su hijo es también un isótopo del Radón el 86Rn220 , conocido también como Torón , que hasta hace pocos años no se ha tenido en cuenta en la radiactividad ambiental por su cortísima semivida, 55,6 s., lo que hace que su difusión desde el punto de producción sea muy pequeña. No obstante, dada la abundancia del Torio existe también una abundante producción de Torón que en determinadas circunstancias puede llegar a ser peligroso como en minas y locales muy poco ventilados.
Tabla No . 4 . Familia radiactiva del 90Th232
Aunque el Torio es un elemento más abundante que el Uranio las actividades globales de ambos son equivalentes porque su periodo es mayor, 1.41x1010 años y por tanto menor su actividad específica. La radiactividad de 1 g. de Torio en equilibrio con sus descendientes produce 0,27 erg./s, (frente a 0,95 erg./s en el Uranio).
Existen en la naturaleza otros elementos radiactivos naturales que no originan largas familias radiactivas. Entre los más relevantes se encuentran el 19K40 (T ½ = 1,25 x 109 años), el 37Rb87 (T ½ = 4,9 x 1010 años), el 71Lu176 (T ½ = 3,6 x 1010 años), el 62Sm147 (T ½ = 1,08 x 1011 años), el 62Sm148 (T ½ = 7 x 1015 años), el 62Sm149 (T ½ = 1 x 1016 años) y el 75Re187 (T½ = 4,5 x 1010 años). De todos ellos el 19K40 es el que juega un papel más importante en el ambiente radiactivo natural y en la vida humana. Actualmente es tan sólo el 0,0117% del Potasio natural pero hay que tener en cuenta que este elemento es muy abundante en la naturaleza. Hay unos 10 kg de Potasio en una Tonelada de arenisca y 35 kg en una de granito.
En el agua del mar hay 380 gramos de Potasio por Tonelada. La energía producida por la desintegración beta del 19K40 es la mayor contribución al calor generado por las sustancias radiactivas en la corteza terrestre y, a lo largo de la historia de la Tierra, la contribución total a la energía suministrada a los océanos por este elemento ha sido considerable. El cuerpo humano contiene un promedio de 140 gramos de Potasio, de los que unos 17 mg son de K40, lo que produce una actividad de unos 3.900 Bq. siendo la sustancia radiactiva predominante en nuestro organismo.
La radiación cósmica La radiación cósmica consiste fundamentalmente en un bombardeo de protones, o núcleos de Hidrógeno, de alta energía, procedentes del espacio exterior. En ella se encuentra también una cierta proporción de electrones y núcleos más pesados, como Helio, e incluso se han llegado a detectar núcleos con número másico superior a 100. Su origen es exterior al sistema solar y en su mayor parte proceden del centro de nuestra galaxia aunque algunos pueden ser de origen extragaláctico.
Se conoce poco sobre el origen de esta radiación y los mecanismos que pueden acelerar las partículas a velocidades próximas a la de la luz.
Se supone que se producen en las explosiones de las supernovas y en los pulsares y adquieren energía también en ondas de choque en el medio interestelar. La energía de estas partículas es muy elevada y se han llegado a detectar partículas con 1020 eV. Su flujo disminuye con la energía, pues 20 años después de haberse detectado por primera vez una partícula con una energía de 1011 GeV solamente se han detectado 10 más. Lo más abundante en la radiación primaria son protones con una energía de unos 2 GeV y los que poseen una energía 1.000 veces mayor tienen un flujo 10 millones de veces menor.
El sol emite en algunas ocasiones, en las llamadas erupciones solares, enormes cantidades de protones que llegan a la tierra con un flujo varios órdenes de magnitud superior al de la radiación cósmica primaria. Sin embargo, sus energías promedio son muy inferiores, se encuentran en el rango de los miles de eV, la máxima puede llegar a 100 MeV, son, pues, protones que se mueven despacio en el mundo subnuclear.
La frecuencia de estos sucesos está ligada al ciclo de 11 años de las manchas solares y aunque las llamaradas son ópticamente visibles durante una hora aproximadamente, el flujo de radiación energética se detecta en la tierra durante unas 48 horas. Estos protones no tienen energía bastante para penetrar en la atmósfera y alcanzar la superficie terrestre y normalmente quedan atrapados en el campo magnético terrestre formando el llamado cinturón exterior de Van Allen. Los más energéticos alcanzan la alta atmósfera y se acumulan en regiones muy estrechas alrededor de los polos magnéticos produciendo las conocidas auroras boreales.
Los protones de la radiación cósmica galáctica al incidir con la alta atmósfera, constituida fundamentalmente por núcleos de Hidrógeno y Helio, producen reacciones nucleares con la formación de otros núcleos y varios piones. Los nuevos núcleos suelen tener altas energías y a su vez producen nuevas reacciones. Los piones son partículas inestables con una masa de unas doscientas setenta veces la del electrón, eléctricamente son cargadas tanto positiva como negativamente o neutras. En la atmósfera se producen, predominantemente, en dirección hacia la superficie terrestre.
Una interacción protón – núcleo puede dar lugar a varios piones. Los piones no llegan a la superficie terrestre, pues su periodo es muy corto, muchos inducen nuevas reacciones nucleares y el resto se desintegra en vuelo en muones y neutrinos. Los piones neutros lo hacen en dos rayos gamma. Los muones son partículas cargadas muy similares al electrón y pueden tener también carga eléctrica positiva, pero con una masa de unas doscientas seis veces la de este. Estos muones son también inestables y se desintegran, en vuelo, en electrones y neutrinos. Sin embargo muchos de ellos llegan a la superficie terrestre y producen reacciones nucleares al interaccionar con los constituyentes de la superficie.
En muchas de estas reacciones se producen neutrones que, a su vez, originan nuevas reacciones nucleares. Los electrones producidos en la atmósfera también son energéticos y producen nuevos electrones y fotones al ionizar los átomos del aire. El número de partículas que pueden llegar a la superficie terrestre procedentes de un único protón cósmico depende de la energía del mismo. Un protón de 6 GeV puede llegar a producir un chaparrón de más de 10.000 millones de partículas en la superficie terrestre.
Aproximadamente el 75% de las partículas de la Radiación Cósmica a nivel del mar son penetrantes y en su mayoría son muones, de ambos signos, que constituyen la parte fundamental de la llamada componente dura.
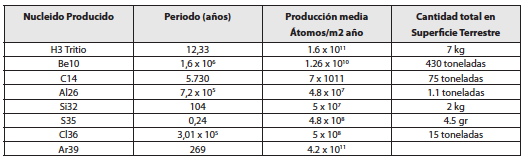
Desde un punto de vista estrictamente radiactivo la radiación cósmica produce, con un ritmo constante, unos 20 radionucleidos diferentes, debido a la interacción de la radiación secundaria con los núcleos de los elementos constituyentes
de la baja atmósfera. Los más abundantes son el Nitrógeno, el Oxígeno y el Argón. Los radionucleidos más relevantes se encuentran en la tabla 5. Tanto la producción como la desintegración de estos radionucleidos cosmogénicos son constantes y por lo tanto su acumulación en la superficie terrestre también lo es. Hay muchos otros con periodos muy cortos como el 17Cl39 con 56 minutos que tienen una menor importancia.
Para los seres vivos el más importante de los radionucleidos cosmogénicos es el 6C14 que se produce al interaccionar neutrones térmicos con núcleos de Nitrógeno y liberarse un protón 7N14 (n, p) 6C14. Como su periodo es muy largo, 5.730 años, el 6C14 se mezcla con todo el Carbono contenido en la atmósfera y la biosfera. Los seres vivos al asimilar el Carbono natural también incorporan la parte correspondiente del Carbono radiactivo. La radiactividad del cuerpo humano debida a este radioisótopo es de unos 3.700 Bq. comparable por tanto a la del 19K40. Sin embargo, la energía emitida por el 6C14 al desintegrarse, mediante un proceso beta, es muy pequeña y su contribución energética es unas 10 veces menor que la del Potasio que lo hace emitiendo radiación gamma de 1.460 keV.
La proporción de 6C14 radiactivo en el Carbono total que contiene un ser vivo es constante mientras vive pero la incorporación del mismo cesa con la muerte. La materia orgánica muerta va perdiendo el Carbono radiactivo por desintegración natural y midiendo su proporción se puede calcular el tiempo que ha transcurrido desde su muerte. Esta es la esencia del método del 6C14 para la determinación de la edad que fue uno de los primeros métodos radiactivos que se utilizó para ese fin y uno de los más exitosos en escalas de tiempo del orden del milenio.
Tabla No . 5 . Radionucleidos más importantes de origen cosmogénico
El Tritio se forma en la alta atmósfera y una parte de él se combina con el Oxígeno formando agua que alcanza la superficie terrestre y se incorpora a las cadenas biológicas. La energía de sus partículas beta es de las menores que se conoce, tan solo 19 keV y su contribución a las dosis totales para el organismo humano es muy pequeña comparada con la del Carbono. Globalmente, aunque su producción es relativamente escasa, 0.5 átomos por centímetro cuadrado y segundo, contribuye con más de 3x1018 Bq a la radiactividad natural de la Tierra.
La radiación cósmica directa no supone un riesgo para los seres vivos en la superficie terrestre, pues los campos magnéticos terrestres y la atmósfera proporcionan un blindaje suficiente. La dosis anual media recibida a nivel del mar es de 0.0003 Sv. Sin embargo, no ocurre lo mismo en la alta atmósfera o el espacio exterior. Durante una erupción solar, como la ocurrida en 1.972 se podrían haber alcanzado dosis letales (10 Sv) en tan solo 24 horas de exposición en la alta atmósfera.
Aunque la experiencia habida hasta la fecha con los cosmonautas en el espacio exterior, no indica problemas debidos a la radiación cósmica directa, hay una dependencia con la altura a que se encuentran las estaciones espaciales. Su inclinación respecto al eje magnético terrestre Norte – Sur es importante para determinar el grado de protección que puede suministrar el campo magnético terrestre. En un satélite a 400 km de altura la dosis media puede llegar a ser de unos 0.32 Sv o sea 1.000 veces superior a la del nivel del mar. La protección de las naves espaciales fuera de la magnetosfera requiere un blindaje de 7 a 9 cm de Aluminio o equivalente. Un blindaje mayor es difícil y poco relevante, ya que un grosor añadido de 20 cm. más tan solo reduce la dosis en algo menos del 20%.
Los vuelos de aviones entre 10 y 20 km de altura suponen también un incremento de la dosis recibida, que puede llegar a los 10 ó 20 µSv por hora de vuelo si no hay erupciones solares que la podrían incrementar en factores 1.000 a 10.000. La normativa de protección radiológica actual considera a las tripulaciones de los aviones como personal profesionalmente expuesto a las radiaciones, ya que el personal de los vuelos transatlánticos puede llegar a acumular dosis anuales superiores a 1 mSv al año que es la máxima permitida para el público en general. Un vuelo España – Estados Unidos de 7 horas supone unos 35 µSv y uno supersónico de 3 horas pero a mayor altura unos 39 µSv. Un mes en la playa supone unos 11 µSv y uno en la alta montaña 36 µSv.
Radio nucleidos artificiales
El hombre ha sido capaz de producir más de un millar de nucleidos artificiales, la mayoría en cantidades muy pequeñas, usados exclusivamente para investigación científica. Casi todos son de periodos muy cortos y su utilidad, por ahora, es muy limitada. No existe ningún elemento químico del que no se conozcan al menos tres isótopos y algunos, como el Cesio, llegan a tener 33. Los isótopos de mayor producción son los que encuentran una aplicación práctica en la ciencia, la medicina o la industria y no sobrepasan las dos docenas.
El problema más importante de la utilización de los radionucleidos es su control y su almacenamiento una vez utilizados. El control está cargo de organismos nacionales que efectúan un seguimiento desde la producción hasta su almacenamiento final. En el caso de España el organismo encargado es el Consejo de Seguridad Nuclear. Lo más difícil es, sin duda, el control durante la utilización del radioisótopo que, inspecciones aparte, tiene que basarse esencialmente en la formación y el buen hacer del usuario.
Para el medio ambiente hay cuatro fuentes importantes de radioisótopos que merecen mención especial. La primera la constituyen los radionucleidos artificiales procedentes de pruebas nucleares en la atmósfera y accidentes nucleares, que podemos medir pero obviamente no podemos controlar.
La segunda es la de los radionucleidos procedentes de la actividad humana en hospitales, laboratorios e industria que podemos medir y controlar, la tercera la de los elementos combustibles irradiados de las plantas nucleares que es quizá la mejor controlada aunque la decisión sobre su almacenamiento o tratamiento final está aún por ser tomada y, la cuarta son el resultante de procesos industriales que utilizan productos naturales que contienen radionucleidos, industrias NORM (Normally Occurring Radioactive Materials) que en proceso industrial se concentran. Los radionucleidos más utilizados en la medicina y en la ciencia y sus características más relevantes se encuentran en la tabla 6.
Tabla No . 6 . Principales radionucleidos artificiales utilizados en medicina, ciencia e industria
La radiactividad liberada al medio ambiente por las explosiones nucleares en la atmósfera ha ido disminuyendo con el tiempo desde que se firmó el tratado que las prohibía y hoy día solo quedan trazas de ellas detectables con equipos muy sofisticados. Lo mismo sucede con las consecuencias medioambientales del accidente de Chernobyl y ambas fuentes son despreciables desde el punto de vista de dosis a las personas.
Dosis equivalente a la población
En la comunidad internacional no hay unanimidad en las dosis máximas permisibles para el público en general que por no tener un seguimiento continuo y detallado son siempre del orden de la décima parte de las del personal profesionalmente expuesto a las radiaciones ionizantes. Por término medio oscilan entre 1 y 5 mSv/año. Estas dosis se entienden añadidas a la procedente de la radiactividad ambiental.
La dosis anual que recibimos de fuentes naturales es en promedio de 0.4 a 4 mSv, pero hay regiones del mundo con dosis mucho más elevadas. La playa de Guarapari en Brasil, que triplica su población en verano, situada a 100 km de Río es rica en Torio y la dosis llega fácilmente a los 175 mSv /año. Lo mismo sucede en el pueblo pesquero de Meaipe con una dosis 50 veces la media. En las costas de Keirala en la India, con más de 90.000 habitantes, las dosis alcanzan los 400 mSv/año y lo mismo sucede en Ramsar en Irán en donde es superior a los 50 mSv. En ninguno de los casos anteriores se ha detectado efecto nocivo alguno en las poblaciones ni mayor incidencia de dolencias o enfermedades.
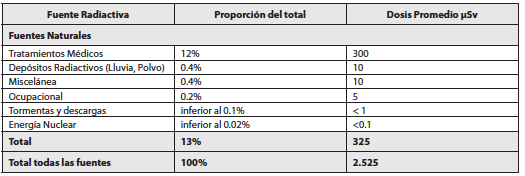
Las contribuciones de distintas fuentes a la dosis equivalente anual que recibe una población se encuentra detallada en la tabla 7. Los datos son promedios y son indicativos para cualquier país occidental. Obviamente un lugar concreto puede presentar valores significativamente distintos debido a la composición del suelo, la altitud sobre el nivel del mar, sismicidad, etc. La contribución más importante que recibe la población procede de fuentes naturales, el 87 %, mientras que las radiaciones artificiales contribuyen tan solo en el 13 %. Entre las fuentes naturales la fuente más importante es el Radón del aire que, por sí solo, alcanza casi al 50% de la dosis equivalente total y si se le añade el Torón lo sobrepasa con creces. El problema del Radón se ha incrementado recientemente con los programas de ahorro energético, que ha aumentado el aislamiento
y disminuido la ventilación de las viviendas, lo que ha originado un significativo incremento del Radón en el aire.
Nuestra radiactividad interna contribuye casi tanto como las fuentes naturales exteriores del orden del 15%. La radiación cósmica contribuye con el 10%. Entre las fuentes artificiales la gran mayoría se debe a los tratamientos médicos sobre todo radiografías. En contra de lo que se cree las pruebas nucleares en la atmósfera, los accidentes nucleares, fundamentalmente Chernobyl, y los vertidos de las instalaciones radiactivas solo contribuyen con el 0.4% de la dosis total. La actividad de las centrales nucleares repercute en un factor 20 veces inferior. En el apartado de miscelánea se incluyen las estimaciones de dosis procedentes de los detectores de humos, fuentes luminosas, televisión y los viajes aéreos. La tabla 7 resume las contribuciones.
Hay que tener en cuenta que la radiactividad ambiental varía de unos lugares a otros e incluso con las condiciones climáticas y estaciones del año y por tanto no son aplicables los valores medios a ningún punto concreto de un país o lugar. En la mayoría de los países existen redes de laboratorios y estaciones automáticas que controlan la radiactividad ambiental de forma permanente y sistemática. Estas dosis no representan ningún peligro para la población, pero el control continuo de la radiactividad ambiental en distintos lugares de un país es necesario para poder determinar cualquier variación anormal de esta.
Tabla No . 7 . Contribuciones de diversas fuentes a la dosis equivalente anual.
CONCLUSIONES
La radiactividad es un fenómeno natural existente en prácticamente todos los lugares de la tierra. Tres son las fuentes ambientales que contribuyen a la radiactividad ambiental, los radionucleidos existentes en el suelo, el agua y el aire, la radiación cósmica con sus radionucleidos cosmogénicos y las fuentes artificiales utilizadas para la medicina, la ciencia y la industria. Las dosis que en promedio recibe la población es esencialmente debida a las fuentes naturales, el 87%, y en ellas el Radón es el causante de la mitad de la misma. Las fuentes artificiales solo contribuyen con el 13%. En cualquier caso estas dosis no representan ningún peligro ni problema para la población.
REFERENCIAS BIBLIOGRÁFICAS
La gran mayoría de libros de física nuclear contienen capítulos dedicados a la radiactividad y tratan estos temas con detalle. Los datos pertinentes aplicables a cada país son publicaciones oficiales de los respectivos organismos reguladores. Para España es el Consejo de Seguridad Nuclear y todas sus publicaciones pueden verse y obtenerse gratuitamente de su página web, http://www.csn.es. Hay organismos internacionales que también se ocupan de la radiactividad, en particular la Organización Mundial de la Salud, la Unión Europea y la "International Commission on Radiological Protection (ICRP)".